Мы уже знаем, что число молекул 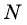 связано с массой вещества
связано с массой вещества 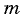 и его молярной массой
и его молярной массой 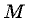 соотношением
соотношением 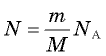 (см. § 24. Количество вещества. Постоянная Авогадро). Подставляя это выражение в соотношение
(см. § 24. Количество вещества. Постоянная Авогадро). Подставляя это выражение в соотношение 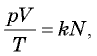 получаем
получаем 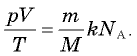
Произведение 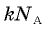 обозначается
обозначается 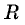 и называется универсальной газовой постоянной. Измерения показали, что
и называется универсальной газовой постоянной. Измерения показали, что 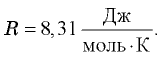 Используя эту постоянную, получаем
Используя эту постоянную, получаем
уравнение Менделеева—Клапейрона: 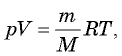 где
где 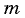 — масса газа,
— масса газа, 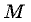 — его молярная масса.
— его молярная масса.
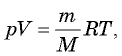 где
где 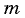 — масса газа,
— масса газа, 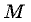 — его молярная масса.
— его молярная масса. Это уравнение было выведено русским ученым Менделеевым во второй половине 19-го века.
